Электролиз - это окислительно-восстановительный процесс, который протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов). Ниже приведены классические формулы электролизов
1.Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → H2 + O2
2. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
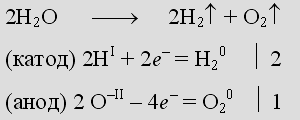


При электролизе воды на аноде выделяется Кислород ([O2]), а на катоде Водород ([H2])
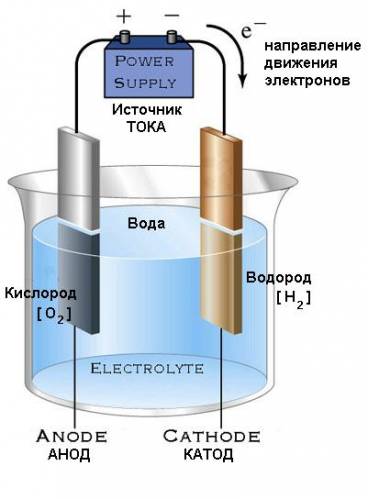
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у "+" будет выделяться кислород, у "-" водород. Именно такое распределение газов происходит из-за того, что возле анода "+" происходит скопление отрицательных ионов OH-, и восстановление кислородда, а возле катода "-" скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na2CO3), имеющие положительный заряд (Na+) и одновременно происходит восстановление водорода. Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li < K < Rb < Cs < Ba < Ca < Na < Mg < Al < Mn < Cr < Zn < Fe < Cd < Co < Ni < Sn < Pb < H2 < Cu < Ag < Hg < Pt < Au
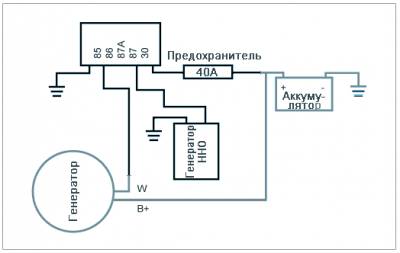
Традиционно для получения водорода и кислорода из воды на автомобилях используют так называемые сухие электролизеры (см. Электролизеры) . Еще их называют Генераторы ННО

Водород и кислород, полученный в двигателе, через генератор ННО путем электролиза, будет значительно ускорять зажигание топливной смеси в цилиндрах вашего двигателя, увеличивая выходную мощность бензинового или дизельного ДВС (Двигателя внутреннего сгорания). Водород зажигается в 1000 раз быстрее, чем испаренное жидкое топливо, тем самым, водород зажигая испаренное жидкое топливо и увеличивая работу взрывной силы поршня, на первой фазе его работы. Преимущества добавления ННО в топливную смесь двигателя внутреннего сгорания, включая дизельные двигатели, были хорошо изучены и документированы как правительством США, так и правительствами других стран, многими крупными университетами и исследовательскими центрами по всему миру.
- ЭЛЕКТРОЛИЗ
-
совокупность электрохим. окислит.-восстановит. процессов, происходящих при прохождении электрич. тока через электролит с погруженными в него электродами. На катоде катионы восстанавливаются в ионы более низкой степени окисления или в атомы, напр.: Fe3+ + e
 Fe2+, Сu2+ + 2е
Fe2+, Сu2+ + 2е  Сu (е - электрон). Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или реагировать с продуктами катодного процесса, к-рые рассматриваются в этом случае как промежут. в-ва Э. На аноде происходит окисление ионов или молекул, поступающих из объема электролита или принадлежащих материалу анода; в последнем случае анод растворяется или окисляется (см. Анодное растворение). Напр.:
Сu (е - электрон). Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или реагировать с продуктами катодного процесса, к-рые рассматриваются в этом случае как промежут. в-ва Э. На аноде происходит окисление ионов или молекул, поступающих из объема электролита или принадлежащих материалу анода; в последнем случае анод растворяется или окисляется (см. Анодное растворение). Напр.: 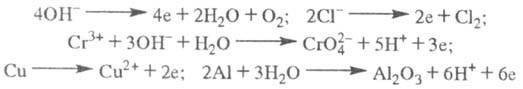
Э. включает два процесса: миграцию реагирующих частиц под действием электрич. поля к пов-сти электрода и переход заряда с частицы на электрод или с электрода на частицу. Миграция ионов определяется их подвижностью и числами переноса (см. Электропроводность электролитов}. Процесс переноса неск. электрич. зарядов осуществляется, как правило, в виде последовательности одноэлектронных р-ций, т. е. постадийно, с образованием промежут. частиц (ионов или радикалов), к-рые иногда существуют нек-рое время на электроде в адсорбир. состоянии.
Скорости электродных р-ций зависят от состава и концентрации электролита, материала электродов, электродного потенциала, т-ры, гидродинамич. условий (см. Электрохимическая кинетика). Мерой скорости служит плотность тока -кол-во переносимых электрич. зарядов через единицу площади пов-сти электрода в единицу времени. Кол-во образующихся при Э. продуктов определяется Фарадея законами. Дня выделения 1 грамм-эквивалента в-ва на электроде необходимо кол-во электричества, равное 26,8 А* ч. Если на каждом из электродов одновременно образуется неск. продуктов в результате ряда электрохим. р-ций, доля тока (в %), идущая на образование продукта одной из р-ций, наз. выходом данного продукта по току.
В электродном процессе участвуют в-ва, требующие для переноса заряда наименьшего электрич. потенциала; это м. б. не те в-ва, к-рые обусловливают перенос электричества в объеме р-ра. Напр., при Э. водного р-ра NaCl в миграции участвуют ионы Na+ и Сl+, однако на твердых катодах ионы Na+ не разряжаются, а протекает энергетически более выгодный процесс разряда протонированных молекул воды: Н 3 О+ + е --> 1/2H2 + Н 2 О.Применение Э. Получение целевых продуктов путем Э. позволяет сравнительно просто (регулируя силу тока) управлять скоростью и направленностью процесса, благодаря чему можно осуществлять процессы как в самых "мягких", так и в предельно "жестких" условиях окисления или восстановления, получая сильнейшие окислители и восстановители. Путем Э. производят Н 2 и О 2 из воды, С12 из водных р-ров NaCl, F2 из расплава KF в KH2F3.
Гидроэлектрометаллургия - важная отрасль металлургии цветных металлов (Сu, Bi, Sb, Sn, Pb, Ni, Co, Cd, Zn); она применяется также для получения благородных и рассеянных металлов, Мn, Сr. Э. используют непосредственно для катодного выделения металла после того, как он переведен из руды в р-р, а р-р подвергнут очистке. Такой процесс наз. электроэкстракцией. Э. применяют также для очистки металла - электролитич. рафинирования (электрорафинирование). Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов.
Э. расплавов электролитов - важный способ произ-ва мн. металлов. Так, напр., алюминий-сырец получают Э. криолит-глиноземного расплава (Na3AlF6 + A12O3), очистку сырца осуществляют электролитич. рафинированием. При этом анодом служит расплав А1, содержащий до 35% Сu (для утяжеления) и потому находящийся на дне ванны электролизера. Средний жидкий слой ванны содержит ВаС12, A1F3 и NaF, a верхний - расплавленный рафинир. А1 и служит катодом.
Э. расплава хлорида магния или обезвоженного карналлита - наиб. распространенный способ получения Mg. В пром. масштабе Э. расплавов используют для получения щелочных и щел.-зем. металлов, Be, Ti, W, Mo, Zr, U и др.
К электролитич. способам получения металлов относят также восстановление ионов металла другим, более электро-отрицат. металлом. Выделение металлов восстановлением их водородом также часто включает стадии Э.- электрохим. ионизацию водорода и осаждение ионов металла за счет освобождающихся при этом электронов. Важную роль играют процессы совместного выделения или растворения неск. металлов, совместного выделения металлов и мол. водорода на катоде и адсорбции компонентов р-ра на электродах. Э. используют для приготовления металлич. порошков с заданными св-вами.
Другие важнейшие применения Э.- гальванотехника, электросинтез, электрохимическая обработка металлов, защита от коррозии (см. Электрохимическая защита).Электролизеры. Конструкция пром. аппаратов для проведения электролитич. процессов определяется характером процесса. В гидрометаллургии и гальванотехнике используют преим. т. наз. ящичные электролизеры, представляющие собой открытую емкость с электролитом, в к-рой размещают чередующиеся катоды и аноды, соединенные соотв. с отрицат. и положит. полюсами источника постоянного тока. Для изготовления анодов применяют графит, углеграфитовые материалы, платину, оксиды железа, свинца, никеля, свинец и его сплавы; используют малоизнашивающиеся титановые аноды с активным покрытием из смеси оксидов рутения и титана (оксидные рутениево-титановые аноды, или ОРТА), а также из платины и ее сплавов. Для катодов в большинстве электролизеров применяют сталь, в т. ч. с разл. защитными покрытиями с учетом агрессивности электролита и продуктов Э., т-ры и др. условий процесса. Нек-рые электролизеры работают в условиях высоких давлений, напр, разложение воды ведется под давлением до 4 МПа; разрабатываются электролизеры и для более высоких давлений. В совр. электролизерах широко применяют пластич. массы, стекло и стеклопластики, керамику.
Во мн. электрохим. произ-вах требуется разделение катодного и анодного пространств, к-рое осуществляют с помощью диафрагм, проницаемых для ионов, но затрудняющих мех. смешение и диффузию. При этом достигается разделение жидких и газообразных продуктов, образующихся на электродах или в объеме р-ра, предотвращается участие исходных, промежут. и конечных продуктов Э. в р-циях на электроде противоположного знака и в приэлектродном пространстве. В пористых диафрагмах через микропоры переносятся как катионы, так и анионы в кол-вах, соответствующих числам переноса. В ионообменных диафрагмах (мембранах) происходит перенос либо только катионов, либо анионов, в зависимости от природы входящих в их состав ионогенных групп. При синтезе сильных окислителей используют обычно без-диафрагменные электролизеры, но в р-р электролита добавляют К 2 Сr2 О 7. В процессе Э. на катоде образуется пористая хромит-хроматная пленка, выполняющая ф-ции диафрагмы. При получении хлора используют катод в виде стальной сетки, на к-рую наносят слой асбеста, играющий роль диафрагмы. В процессе Э. рассол подают в анодную камеру, а из анодной камеры выводят р-р NaOH.
Электролизер, применяемый для получения магния, алюминия, щелочных и щел.-зем. металлов, представляет собой футерованную огнеупорным материалом ванну, на дне к-рой находится расплавленный металл, служащий катодом, аноды же в виде блоков располагают над слоем жидкого металла. В процессах мембранного получения хлора, в электросинтезе используют электролизеры фильтр-прессного типа, собранные из отд. рам, между к-рыми помещены ионообменные мембраны.
По характеру подключения к источнику питания различают монополярные и биполярные электролизеры (рис.). Монополярный электролизер состоит из одной электролитич. ячейки с электродами одной полярности, каждый из к-рых может состоять из неск. элементов, включенных параллельно в цепь тока. Биполярный электролизер имеет большое число ячеек (до 100-160), включенных последовательно в цепь тока, причем каждый электрод, за исключением двух крайних, работает одной стороной как катод, а другой как анод. Монополярные электролизеры обычно рассчитаны на большой ток и малые напряжения, биполярные - на сравнительно небольшой ток и высокие напряжения. Совр. электролизеры допускают высокую токовую нагрузку: монополярные до 400-500 кА, биполярные эквивалентную 1600 кА.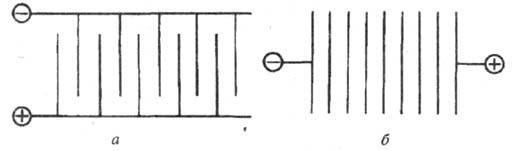
Схема подключения к источнику внеш. тока монополярного (а)и биполярного (б)электролизеров.
Простой электролиз (горение газа)
Разрыв ячейки при увеличении вольтажа
Для автомобиля, время определило практическое применение биполярного электролизера.
Конструкции разные, но эффективность использования именно этого типа доказана временем.
Схема подключения сухого электролизера, без ШИМ-модулятора тока
******************************
Электролиз -Водные растворы солей
Физика разложения воды при электролизе